耐熱性に優れた酵素発見、血糖値センサー向け:高温地域に住む糖尿病患者に朗報
東京工科大学の研究グループは、好熱性糸状菌からグルコース脱水素酵素(GDH)を発見した。この酵素は耐熱性と長期安定性に優れており、高温地域で使用される血糖値センサーチップなどへの応用が期待される。
高温環境での利用や長期保存が可能に
東京工科大学応用生物学部の横山憲二教授らの研究グループは2017年1月、好熱性糸状菌から、グルコース脱水素酵素(GDH)を発見したと発表した。この酵素は耐熱性と長期安定性に優れているため、高温地域で使用される血糖値センサーチップなどへの応用が期待されている。
糖尿病患者は、自己血糖値センサーなどを用いて血糖値の管理を行う。これらのセンサー素子にはこれまで、グルコースオキシダーゼやピロロキノリンキノン依存型GDHあるいはフラビンアデニンジヌクレオチド依存型GDH(FAD-GDH)などが一般的に用いられてきたという。ところが、これまでの酵素を活用する血糖値センサーは、高温環境での利用や常温での長期保存には適していなかった。
そこで研究グループは、従来と比べ耐熱性と長期安定性に優れたFAD-GDHを取得するために、好熱性糸状菌から同酵素の遺伝子のスクリーニングを行い、大腸菌と酵母を用いて作製することとした。
具体的に研究グループは、32株の好熱性糸状菌に対し、Aspergillus属FAD-GDH遺伝子に基づいて設計した縮重プライマーを用い、ゲノムDNAを鋳型とする縮重PCR(Polymerase Chain Reaction)を行った。そうしたところ、複数の株で、FAD-GDH遺伝子と高い相同性を有する遺伝子断片が増幅されていることを確認した。この遺伝子断片をプローブとしてFAD-GDH全領域を包括するゲノムDNAをクローニングで増やし、大腸菌と酵母を用いてこの遺伝子がコードするタンパク質を発現させた。
分泌シグナル配列を除去することで、可溶性画分から好熱性糸状菌Talaromyces emersonii、Thermoascus crustaceus由来タンパク質を精製することができた。精製したタンパク質の吸収スペクトルを測定/分析したところ、380nmと450nm付近の領域でそれぞれピークを観測することができた。これにより、グルコースを基質としFADを補因子とする酵素FAD-GDHであることが分かった。このFAD-GDHは、常温性Aspergillus oryzae FAD-GDHよりも高い熱安定性を示したという。
今回発見した酵素は、耐熱性に優れ長期保存が可能なことから、東南アジアやインド、アフリカなど高温地域において利用される血糖値センサーチップにも適用できるとみている。
関連記事
 さらに進化したIoT機器がCESで一堂に会する
さらに進化したIoT機器がCESで一堂に会する
「CES 2017」(2017年1月5〜8日、米国ラスベガス)には多数のスマートデバイスが展示された。これらは明らかに今まで以上にスマート化を遂げている。 ヘルスケア/ウェルネス機器の開発期間を短縮
ヘルスケア/ウェルネス機器の開発期間を短縮
Maxim Integrated Productsは、ウェアラブルタイプのヘルスケア/ウェルネス機器の開発期間を大幅に短縮できる開発プラットフォーム「hSensor Platform」を発表した。 4人の研究から始まった山形大発プリンテッドエレ
4人の研究から始まった山形大発プリンテッドエレ
山形大学有機エレクトロニクス研究センター(ROEL)の時任静士教授と熊木大介准教授らは2016年5月、プリンテッドエレクトロニクスの研究開発成果を事業展開するベンチャー「フューチャーインク」を設立した。時任氏と熊木氏に、今までの研究内容や今後の事業展開について話を聞いた。 ルネサス、ヘルスケア領域へ本格参入
ルネサス、ヘルスケア領域へ本格参入
ルネサス エレクトロニクスは2020年にヘルスケア/医療機器市場で売上高150億円を達成すべく、2016年4月に専門部署を立ち上げ、同市場に対し高付加価値のシステム提案を強化する方針だ。 生体組織に直接貼り付け、体温の分布を測定
生体組織に直接貼り付け、体温の分布を測定
東京大学の染谷隆夫氏らは、「nano tech 2016 国際ナノテクノロジー総合展・技術会議」で、体に直接貼り付けることが可能なフレキシブル体温計などの開発品をデモ展示した。柔らかい有機デバイスをバイオ医療に応用していく。 血糖値を測るインク、米大学が開発
血糖値を測るインク、米大学が開発
米大学が、血糖値(グルコース濃度)を測定できるインクを開発したと発表した。生体適合性のあるインクで、市販のボールペンに充填して使うという。線などを皮膚の上に直接書いて、血糖値をモニタリングすることが可能になるかもしれない。
Copyright © ITmedia, Inc. All Rights Reserved.
記事ランキング
- ローム、TSMCのライセンス取得し650V GaNパワー半導体を自社生産へ
- 定年間際のエンジニアが博士課程進学を選んだ「本当の理由」
- Intelとソフトバンク子会社が次世代メモリ開発へ 29年度に実用化
- AIは「バブル」ではない――桁違いの計算量が半導体に地殻変動を起こす
- TIがSilicon Labsを75億ドルで買収する理由
- AI時代のニーズ捉え開発加速、キオクシア次期社長の展望
- ソシオネクスト増収減益、中国向け車載新規品は順調に増加
- SAIMEMORYの新構造メモリ 低消費電力に焦点
- 三菱電機の半導体は光デバイス好調 3Q受注高49%増
- TSMCは2nmで主導権維持、SamsungとIntelに勝機はあるか

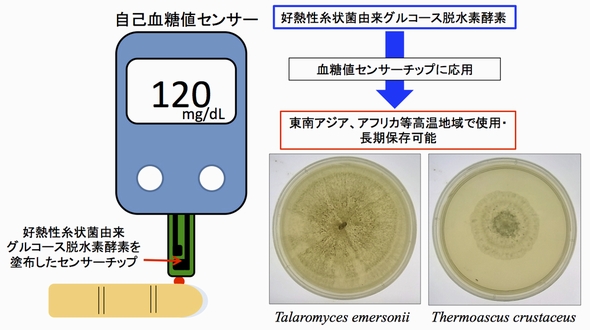 好熱性糸状菌グルコース脱水素酵素を用いた自己血糖値センサーの概念図 出典:東京工科大学
好熱性糸状菌グルコース脱水素酵素を用いた自己血糖値センサーの概念図 出典:東京工科大学