1ミリでいいからコロナに反撃したいエンジニアのための“仮想特効薬”の作り方:世界を「数字」で回してみよう(63) 番外編(3/7 ページ)
RNAを自在に切断、分解する方法は既知の技術
では、ここからはシバタ先生のメール(青い枠内)を引用しながら、お話を進めさせて頂きたいと思います。
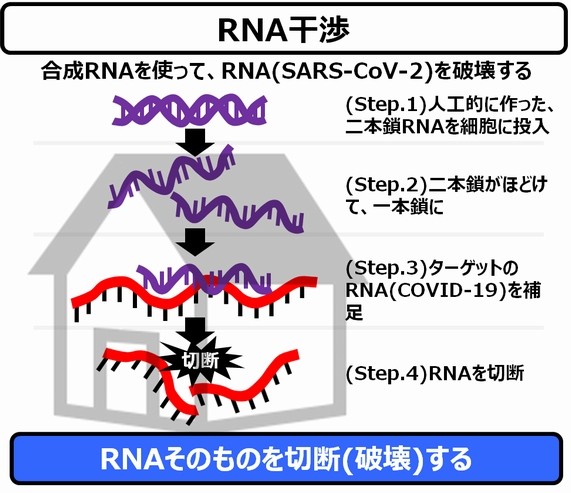
細胞の中にあるRNAを自在に切断、分解する方法は、実は既に公知の技術です。
これが、2006年の秋に、アンドリュー・ファイアーとクレイグ・メローによって発見された「RNA干渉」という技術です(ノーベル賞(医学生理学賞)を受賞し、世界中に知れ渡りました)。
この技術を使えば、狙いを定めた特定のRNAを分解し、活動を抑制できるのです。
具体的には、「タンパク質を製造する伝令RNAを破壊することで、目的のタンパク質を作れなくする技術」です。この方法の優れた点は、本家のゲノム上の遺伝子の情報を変えなくても、ターゲットである遺伝子がタンパク質に翻訳されるところを「邪魔」することができる点にあります。
この発明以後、「このRNA配列の、この部分を切断したい」「あのRNAの発現量を落としたい」というようなことがほぼ自由自在にできるようになったのです。
さて、RNA干渉を起こす小さなRNA分子(この小さなRNAをsiRNAと言います)をターゲットに対して特異的に設計することで、理学部、工学部、医学部における生命研究の幅は、爆発的に広がりました。
まさにノーベル賞にふさわしい大発見でした。そして、理論上、コロナウイルスのゲノムはRNA干渉技術で分解可能です。
siRNA(small interfering RNA)とは、超短い二本鎖のRNAで、塩基(A,G,C,T)の対がたかだか21〜23個程度です(後で説明しますが、SARS-CoV-2の塩基対が3万個に比べると、本当に短いです)。
これで、理論上は、伝令RNA(mRAN)をぶっ壊せるようなのです。
思い出して頂きたいのですが、SARS-CoV-2が自分のレプリカを作る時の出発点はゲノムRNAなのです。製造するタンパク質うんぬんは、このRNAあっての話であり、RNAさえ壊せれば、ぶっちゃけ「どーでもいい」のです。
つまり
―― ピンポイントの、siRNAを見つけ出せれば、SARS-CoV-2のRNAを破壊できる
ということです。
それはさておき、先ほど、SARS-CoV-2は、失敗したコピペを修正する機能を有する酵素を持っている、というお話をしました。
これでは、既存の抗ウイルス薬の仕組みでは対抗できないという話にならないのか、不安になってきましたので、シバタ先生に質問してみました。
「RNA干渉」の話をする前に、まず、C型慢性肝炎治療薬として開発された抗ウイルス薬の一つである「リバビリン」についてお話します。
「RNAを合成する」とは、RNAの鎖を連結する反応を進めていくことなのですが、このリバビリンは、この連結を妨害する働きをします。
ところが、新型コロナウイルス(SARS-CoV-2)は、聞くところによると(こちらを参照)どうやら優秀な校正作用付きの酵素を作り出す遺伝情報をゲノム上に持っているらしいです。
コロナウイルスがRNA鎖を合成するときに、不良材量であるリバビリンを忍び込ませても、検品(酵素の校正作用)でその不良材料(リバビリン)がはじかれてしまうので、正常な製品(次の世代のコロナウイルスゲノム)が完成してしまうのです。おそるべし、コロナウイルス!!*)
(*)ちなみにこのリバビリン、もともと抗インフルエンザ薬として開発されましたが、効果はイマイチでした。SARS-CoV-2だけではなく、インフルエンザウイルスのRNA合成酵素もそこそこの「校正作用」を持っているらしいです。)
つまり、SARS-CoV-2は、自分のレプリカの失敗作品を、自動的に廃棄してしまい、100%の純正製品のみを、せっせと作り続けることができるということですね。
あれ? それでは、「RNA干渉」でもSARS-CoV-2の校正機能付きの酵素に対抗できない、ということになりませんか?
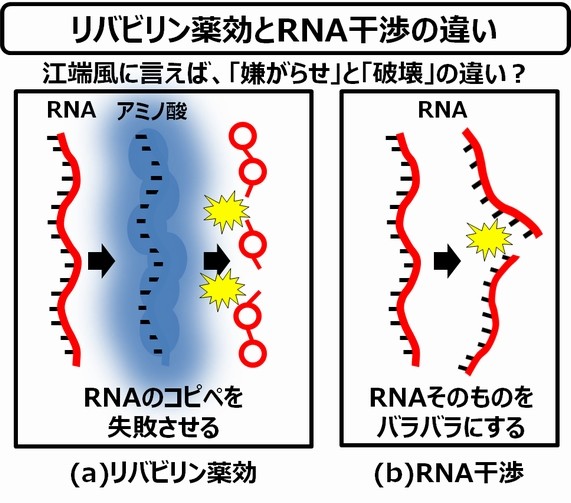
少し整理してみましょう。先ほどお話した「リバビリン」と「RNA干渉」は、その機能が異なります。
「リバビリン」は、「RNAを合成中に阻害物質(生産ラインに不良材料)を投げ込む、というイメージなります。
一方、「RNA干渉」では、複製に使用する鋳型そのものを破壊・切断する(生産ラインの設計図を使い物にならなくする)ことになりますので、不良材料を投げ込む必要もなく、勝負をつけることができるのです。
つまり、「リバビリン」は「SARS-CoV-2のレプリカ製造の妨害」をしているだけですが、「RNA干渉」は「SARS-CoV-2のレプリカ製造プロセスそのものを破壊する」ということになります。
つまり、「優秀な校正作用付きの酵素」が動き出す前に、本体を破壊してしまうのです。
おお! では、SARS-CoV-2を切断する酵素さえ発見すれば、このパンデミックに人類は勝利することができる訳ですね!
ただ、SARS-CoV-2が、まだ他に何かを仕込んでいる可能性は否定できません。例えば、未知の作用(単にシバタにとって未知or世界的に未知である作用)によって、RNA干渉にさらに干渉する酵素をコロナウイルスが持っている可能性はゼロでは無いと思っています。
あ、やっぱり、そうなんですか。そんな簡単な話ではないんですねーー。
しかも、その狙った配列、もしくはその配列とよく似た配列が、ヒトの重要な遺伝子に含まれている可能性も、ちゃんと考えないといけません。
そうしないと、うっかりヒトの重要なRNAを阻害してしまう可能性があるからです。そうなれば、重大な副作用の原因になってしまう……この、「ターゲット以外にも作用してしまうよ」を、オフターゲット効果といいます。
siRNAの長さは約21塩基くらいで、ものすごく短いモノですから、SARS-CoV-2以外の正常な細胞やRNAも攻撃してしまう、とうことですね。
しかし、その一方で、ヒトの全ゲノム解析は既に終了し、メッセンジャーRNA(mRNA)配列も相当既知になっていますので、オフターゲット効果は、設計段階でかなり除外することが(RNA干渉発見当時よりは)可能になってきています。
つまり、コンピュータの中での、新しく作り出したsiRNAの塩基列で、ヒトの全ゲノムを攻撃(シミュレーション)して、人ゲノムに影響が出るものは、候補から外してしまえば良い、ということですね。
でも、それでも、予備実験、動物実験、臨床試験などは必ず必要です。何事も、最終的にはやってみないと分からないのです。
そりゃまあ、いきなり人間に試すことはできませんよね。私も、コンピュータの計算結果と、現実世界の結果が乖離することは、山ほど経験し尽しています。
とはいえ、このSARS-CoV-2の災禍がいつまで続くかは分かりませんが、新薬開発は、人類の存亡をかけた喫緊(きっきん)の課題ですよね。
シバタ先生ほか、先端医療や医薬開発のエンジニアの皆さまの知性と努力に、心から期待しています。
江端さん。他人事のように言ってはなりません。
――――― えっ?
例えば、抗ウイルス活性部位のインシリコによる予測および、抗ウイルス活性物質のインシリコによる設計というものがあります。これは、どちらかというと、江端さんのほうが専門かも知れません。
すみません。全然、知りませんでした。
従来は、試薬を手で混ぜ混ぜしながら実験を進めるwet laboratoryしかありませんでしたが、最近ではコンピュータ上で創薬のコア情報を導き出す、dry laboratoryも重要な分野に成長しています。
インシリコ、つまり、コンピュータープログラム上で、ウイルスが産生する酵素の構造を予測し、その酵素を阻害する可能性のある分子構造を予測することをin-silico screeningとか、in-silico medicineと言うそうです。
……でも、シバタ先生、それはですね……(ここから、冒頭の『医薬の設計製造は、高度な医療知識がある一部のエリートと、スパコンの仕事』という、江端の思い込みが再発動する)
最近は、dry laboratoryの論文も増えてきました。私(シバタ)には、全く手が出せない分野なので、「ほんとに役に立つのかよ」と思った時期もありましたが、、、思いも付かない創薬シーズを見つけ出してくれる可能性もあるらしいですし、wet labがdry labと共存する未来は必然のようです。
外から眺めている感じとしては、まだまだ発展途上の分野のようです。門外漢なので、私も用語を知っている程度です。
……はい、分かりました。いずれにしても、これは私の仕事ですね。ちゃんと調査して、後ほどシバタ先生にレポートを提出致します。
Copyright © ITmedia, Inc. All Rights Reserved.
記事ランキング
- 2026年半導体市場の3大トピックを深掘り ―― DRAM不足の真相とTSMC、Intelの逆襲
- NANDを再定義、HBMを補完するAI用メモリ技術「HBF」
- IntelがTowerとの製造契約撤回を表明
- 2nm世代以降のGAAチップの性能向上へ、AMATの新装置
- NORフラッシュにもAI需要の波、迫る供給危機
- ルネサスがGFと協業、米国での半導体製造を加速
- インターポーザに複数のシリコンダイを近接して並べる2.5次元集積化
- WD、2029年に100TB HDD実現へ 「SSDとの差」縮小も狙う
- TELが掲げる「半導体製造のDX」 最大の課題は何か
- JX金属がインジウムリン基板増産、30年に3倍に