フルクトース脱水素酵素の構造と反応機構を解明:第三世代バイオセンサーに応用
京都大学と大阪大学の研究グループは、酢酸菌由来のフルクトース脱水素酵素(FDH)に関する構造解析に成功し、酵素の反応機構を解明した。生体物質の検出に適した第三世代バイオセンサーへの応用が期待される。
2.5Åの分解能で立体構造を解明、電極反応部位の特定も
京都大学と大阪大学の研究グループは2023年10月、酢酸菌由来のフルクトース脱水素酵素(FDH)に関する構造解析に成功し、酵素の反応機構を解明したと発表した。生体物質の検出に適した第三世代バイオセンサーへの応用が期待される。
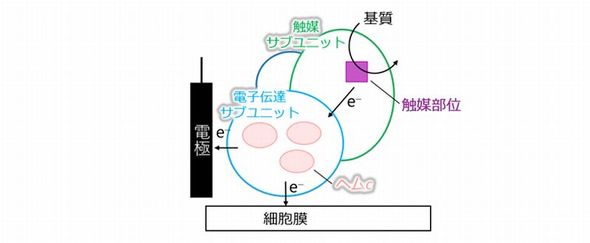
FDHは、酢酸菌の呼吸鎖電子伝達系を構成する膜結合型タンパク質である。電極を基質と認識し、「直接電子移動(DET)型反応」という極めて珍しい反応を示すという。酵素と電極材料だけで構成されるシンプルな反応系で、生体や環境への適合性にも優れている。しかし、DET型反応機構についてはまだ解明されていなかったという。
研究グループは、DET型反応のモデル酵素として、フラボ/キノ/メタロヘモタンパク質に着目してきた。この酵素群は、触媒部位としてフラビンアデニンジヌクレオチド(FAD)またはピロロキノリンキノン(PQQ)、モリブデンコファクター(Moco)を保有する「触媒サブユニット」、酵素の発現を担う「サブユニット」および、ヘムcを保有する「電子伝達サブユニット」からなるヘテロトリマーである。
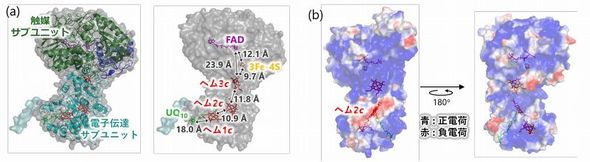
研究グループは今回の実験で、2つの成果を得た。その1つは「FDHの立体構造解明と電極反応部位の特定」である。FDHの単粒子像解析では、大阪大学大学院生命機能研究科日本電子YOKOGUSHI協働研究所にあるクライオ電子顕微鏡を用い、2.5Åという分解能で立体構造を解明した。これにより、触媒サブユニットにFADと鉄硫黄クラスター(3Fe-4S)を、電子伝達サブユニットに3つのヘムcを確認した。同時に、ユビキノン(UQ10)の結合部位も解明した。
また、作成した酵素表面の静電ポテンシャルマップから、ヘム2c付近に負電荷が局在していることが分かった。これを基に、電極表面修飾法を活用し酵素のDET型反応を電気化学的に評価した。この結果、負電荷を帯びた酵素表面と正電荷を帯びた電極表面の間の静電引力によって、正電荷修飾電極で酵素のDET型活性が向上することを確認した。これらの状況から、ヘム2cを電極反応部位として特定した。
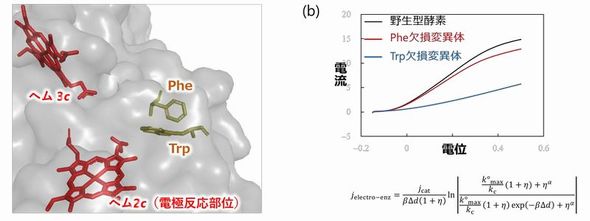
もう1つの成果は、「DET型活性に関与するアミノ酸残基の特定」である。ヘム2cから酵素表面までの電子移動経路上には、フェニルアラニン(Phe)およびトリプトファン(Trp)という、「芳香族アミノ酸」に分類される2種類のアミノ酸が存在していることを確認した。芳香族アミノ酸はタンパク質内部の電子移動を促進することが報告されている。そこで、DET型反応においても、同様の現象が生じていないか検証した。
実験では、PheとTrpをそれぞれ別のアミノ酸に置き換えた変異型FDHを作製し、電気化学特性を評価した。この結果、Trpを置き換えた変異体は、ボルタモグラムの形状が大きく変化し、電流値の大きさは野生型酵素の半分以下となった。数理モデルでボルタモグラムを解析すると、変異体は酵素−電極間の電子移動速度が野生型酵素の3分の1に低下することが分かった。
今回の研究成果は、京都大学大学院農学研究科の鈴木洋平博士課程学生や宋和慶盛助教、北隅優希同助教、白井理同教授、京都大学産官学連携本部の加納健司特任教授、大阪大学大学院生命機能研究科日本電子YOKOGUSHI協働研究所の牧野文信招へい准教授、宮田知子同特任准教授(常勤)、難波啓一同特任教授(常勤)および、大阪大学蛋白質研究所の田中秀明准教授らで構成される共同研究グループによるものである。
関連記事
 レドックスフロー電池、二酸化炭素を活物質化
レドックスフロー電池、二酸化炭素を活物質化
産業技術総合研究所(産総研)は、触媒により二酸化炭素を活物質化し、これを利用した「レドックスフロー電池」を、京都大学と共同で開発した。さまざまな化合物に触媒技術を応用すれば、新たな材料開発につながる可能性が高いとみている。 スピン偏極率が約95%の「キラルTiS2」を合成
スピン偏極率が約95%の「キラルTiS2」を合成
京都大学は、層状化合物である「二硫化チタン(TiS2)」の層間に、「キラル分子」を挿入した物質「キラルTiS2」を開発した。この物質に電流を流すと、電流中のスピンがほぼ平行にそろうことが分かった。 ゼロ磁場下で超伝導ダイオード効果を磁化制御
ゼロ磁場下で超伝導ダイオード効果を磁化制御
京都大学らによる研究グループは、薄膜積層方向に極性構造を有する超格子において、ゼロ磁場下で超伝導ダイオード効果を磁化制御することに成功した。今回の成果は、超低消費電力の不揮発性メモリや論理回路の実現に貢献するとみられる。 京大ら、イッテルビウム化合物で中性準粒子を発見
京大ら、イッテルビウム化合物で中性準粒子を発見
京都大学と広島大学の研究グループは、イッテルビウム化合物「YbCuS2」の非整合反強磁性秩序相に、電気的中性な準粒子が存在していることを発見した。次世代量子コンピュータや省エネルギーメモリデバイスなどへの応用が期待できるという。 京都大ら、電子誘電体の圧電性と強誘電性を実証
京都大ら、電子誘電体の圧電性と強誘電性を実証
京都大学、名古屋工業大学およびオックスフォード・インストゥルメンツらによる研究グループは、電子誘電体と呼ばれる酸化物「TmFe2O4」が、室温において圧電体かつ強誘電体になることを実証した。 PCSELの高輝度化に成功、大型レーザー並みに
PCSELの高輝度化に成功、大型レーザー並みに
京都大学の研究グループは、フォトニック結晶レーザー(PCSEL)について、連続動作状態での輝度を1GWcm-2sr-1 まで高めることに成功した。この輝度は、CO2レーザーや固体レーザー、ファイバーレーザーなど大型レーザーに匹敵する値だという。
関連リンク
Copyright © ITmedia, Inc. All Rights Reserved.
記事ランキング