米政府機関、デジタルヘルスケア製品のガイドライン策定へ:ビジネスニュース 業界動向
デジタルヘルス製品の増加に対応すべく、米国食品医薬品局(FDA:Food and Drug Administration)は、これらの製品の安全対策やソフトウェアのガイドラインについて整えていく方針だ。
米国食品医薬品局(FDA:Food and Drug Administration)のシニア政策顧問は、米国カリフォルニア州サンノゼで開催された医療部材の展示会「BIOMEDevice」(2014年12月2〜3日)で、「FDAは、デジタルヘルス製品の増加に対応するために、安全対策やソフトウェアのガイドラインの定義や合理化を進めている」と述べた。
FDA医療機器・放射線保健センター(CDRH:Center for Devices and Radiological Health)のBakul Patel氏は、「コネクテッドヘルスは目覚ましい勢いで進歩している。われわれは、予防を基本としたヘルスケアが、よりよい成果につながると確信していて、そのためには、次世代のヘルスケアの枠組みの構築が急務となっている」と述べる。
ガイドラインの第1版を公開
FDAは、医療機器の設計プロセスに安全対策を組み込んだガイドラインの第1版を公開した。また、同局は近頃、サイバー攻撃を監視し対処する方法を模索するための第一歩としてワークショップを開催した。Patel氏は、「問題に対して事前に策を講じられるように、現在取り組みを進めている」と述べている。
これとは別に、FDAは世界の各種機関と協力して、医療機器向けソフトウェアを規制する共通ガイドラインの策定に取り組んでいる。Patel氏は、医療機器規制当局の国際会議「IMDRF(International Medical Device Regulators Forum)」で、医療機器向けソフトウェアワーキンググループのチェアマンを務める。同ワーキンググループは、ソフトウェアの規制に関するフレームワークの第1版(30ページ)を発行している。
同グループは、ヘルスITソフトウェアの扱いについても定義することを目指している。ただし第1案では、ヘルス管理プログラムに関しては、政府の規制よりも業界の品質基準を適用することを推奨している。
一方、Samsung Electronicsがシリコンバレーに置くOpen Innovation Center(OIC)で医療機器部門のプリンシパルを務めるAndrew Atwell氏は、BIOMEDeviceの基調講演で、「規制当局との協力体制を整えることが重要だ」と語った。
BIOMEDeviceは、規制当局から新製品の認可を受ける方法を知るために参加する企業も少なくない。Atwell氏はこうした参加者に対して、「FDAを恐れる必要はない」と述べる。同氏は、「FDAは職員を特定の企業に配属させることもある。そうした場合、個人的な人間関係も重要となる。信用と実績を築くことが、認可を受ける近道になる場合もある」と語った。
同氏は、「とはいえ、まず欧州の規制当局で医療機器製品の認可を受ける企業も多い。欧州の方が迅速に認可が下りるためだ。認証マーク発行までのプロセスがスムーズに進むことから、多くの企業がEU(欧州連合)で申請を行っているのが現状だ。EUでは認可が却下されることは少ない。さらに、EUの承認データをFDAに移管できる場合もある」と説明した。
Atwell氏は、民生機器のヘルスケア機能を別モジュールで設計することを推奨している。そうすることで、製品の完成前にFDAの認可を受けて修正を加えることができるため、改修をよりスムーズに行えるからだ。
【翻訳:滝本麻貴、編集:EE Times Japan】
関連記事
 皮膚アセトン測定で脂肪燃焼が見える、ドコモがデモ
皮膚アセトン測定で脂肪燃焼が見える、ドコモがデモ
NTTドコモは「CEATEC JAPAN 2014」で、皮膚アセトンを測定し、脂肪がどの程度燃焼しているかをスマートフォンで確認できる技術や、スマートフォンを見なくても目的にたどりつける、スティックを使ったナビゲーション技術などを展示した。 「医療」の進化はエレクトロニクスが引っ張る! MEMSセンサー/USB 3.0などを提案
「医療」の進化はエレクトロニクスが引っ張る! MEMSセンサー/USB 3.0などを提案
「MEDTEC Japan 2013」では、医療を進化させる多様なエレクトロニクス技術の提案が行われた。特にセンシング技術や画像処理関連技術などに注目が集まった。 半導体技術で“モバイル医療”の実現へ
半導体技術で“モバイル医療”の実現へ
心臓を専門とする医学研究者は、米国半導体工業会(SIA)のイベントで、心電図をリアルタイムでスマートフォンに表示できる機能などを見せ、半導体技術がもたらす医療の進歩の可能性について話した。医療/ヘルスケア分野が、半導体技術に寄せる期待は大きい。 活用始まる人体無線網、ヘルスケアから新市場が立ち上がる
活用始まる人体無線網、ヘルスケアから新市場が立ち上がる
わざわざ操作しなくても、身の回りにあるさまざまな機器が人間の要望にきちんと応えてくれる…。運動量や体温、心拍数といった生体情報を活用すれば、そんな生活が可能になるかもしれない。 目指すはスタートレックの「トリコーダー」? クアルコムの医療機器開発プロジェクト
目指すはスタートレックの「トリコーダー」? クアルコムの医療機器開発プロジェクト
ウェアラブルな医療機器への注目が高まっている。映画「スタートトレック」に登場する「トリコーダー」のようなモバイル医療診断機器の開発を促進すべく、クアルコムは「Tricoder X-Prize」というプロジェクトを実施する。
Copyright © ITmedia, Inc. All Rights Reserved.
記事ランキング

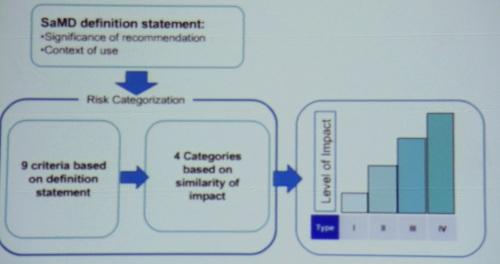 「IMDRF」は、医療用ソフトウェアについて、4つのカテゴリと、9つのリスク基準を設けている
「IMDRF」は、医療用ソフトウェアについて、4つのカテゴリと、9つのリスク基準を設けている